Teadlased töötasid välja operatsiooni mittevajava viisi surmava ajukasvaja – glioblastoomi – raviks, mis tugevdab immuunsust.
Washingtoni Ülikooli Meditsiiniinstituudi teadlased St. Louises on koostöös Northwesterni Ülikooliga väljatöötanud mitteinvasiivse meetodi ühe kõige agressiivsema ja surmavama ajukasvaja raviks. Uus tehnoloogia kasutab nanoosakestest loodud täpselt konstrueeritud struktuuri, mis toimetavad tugeva kasvajavastase ravimi ajju ninasprei kujul. See uus meetod on oluliselt vähem invasiivne kui teised arenduses olevad ravivõtted ning hiirtega tehtud katsetes tõestas see oma tõhusust glioblastoomi ravis, tugevdades aju immuunvastust.
Mis on glioblastoom ja miks seda on raske ravida?
Glioblastoom algab ajurakkudest, mida nimetatakse astrotsüütideks ning on kõige levinum ajukasvaja tüüp, mõjutades ligikaudu kolme inimest 100 000-st USA-s. See kasvaja areneb kiiresti ja on peaaegu alati surmav. Üks peamisi põhjusi, miks ravimid ei suuda seda tõhusalt pidurdada, on see, et nende viimine ajju on äärmiselt keeruline.
„Soovisime muuta seda reaalsust ja luua mitteinvasiivse ravimi, mis aktiveeriks immuunsüsteemi võitluseks glioblastoomiga,“ selgitas uuringu kaasautor Alexander H. Stegh, PhD, neurokirurgia professor ja uurimisjuht The Brain Tumor Center’is Siteman Cancer Centeris. „Oleme näidanud, et täpselt konstrueeritud nanostruktuurid, mida nimetatakse sfäärilisteks nukleiinhapeteks, suudavad ohutult ja tõhusalt aktiveerida aju immuunradasid. See muudab põhjalikult arusaama sellest, kuidas vähiravi immuunsüsteemi abil võib toimida raskesti ligipääsetavates kasvajates.“
„Külmad“ kasvajad muutuvad „kuumaks“ STING-aktivatsiooni abil
Glioblastoomid on tuntud kui „külmad kasvajad“, sest need ei aktiveeri organismi loomulikku immuunvastust. Vastupidiselt „kuumadele kasvajatele“ on neid raske ravida immuunravi abil. Uurijad on aga leidnud viisi, kuidas immuunreaktsiooni esile kutsuda, stimuleerides STING-rada (stimulator of interferon genes) rakkudes – see aktiveerub, kui rakud tuvastavad võõra DNA.
STING-rada aktiveerivad ravimid võivad aidata immuunsüsteemil võidelda, kuid need lagunevad kiiresti ja vajavad süstimist otse kasvajasse. Korduv süstimine otse ajju muudab ravi väga invasiivseks ja valulikuks.
„Soovisime patsiendile võimalikult vähe ebamugavust tekitada ning kasutada sfääriliste nukleiinhapete platvormi ravimite mitteinvasiivseks manustamiseks,” ütles uuringu esimene autor Akanksha Mahajan.
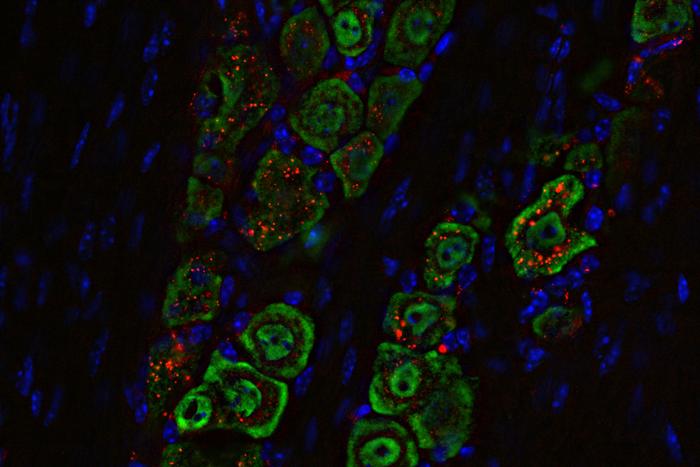
Washingtoni Ülikooli Meditsiinikooli teadlased on välja töötanud nina kaudu manustatava mitteinvasiivse ravimi, mis hävitas hiirtel surmava ajukasvaja. Ravim põhineb sfäärilisel nukleiinhappel ehk nanomaterjalil (punane), mis liigub nina kaudu mööda närviteid (roheline) ajju ning vallandab immuunvastuse, mis elimineerib kasvaja. Foto Washington University School of Medicine in St. Louis
Nanoosakesed jõuavad ajju nina kaudu
Lahenduse leidmiseks tehti koostööd Northwesterni Ülikooli keemiaprofessoriga ja nanotehnoloogia pioneeriga Chad A. Mirkiniga. Tema loodud sfäärilised nukleiinhapped sisaldavad DNA- või RNA-jadasid tihedalt ümbritseva nanotuuma ümber, suurendades ravitoimet. Uurijad lõid uue ravimiklassi, mille kuldsed nanotuumad aktiveerivad STING-rada teatud immuunrakkudes. Ravimi toimetamiseks ajju kasutati ninna pritsimist.
Varasemalt on nina kaudu manustamist kaalutud ravimite jaoks, mis peavad ajju jõudma, kuid mitte ühtegi nanosuuruses ravimit ei olnud selleks kasutatud ega suunatud immuunsüsteemi aktiveerimisele ajukasvajate vastu.
„See on esimene kord, kui suudame nina kaudu ajju toimetatud nanosuuruses ravimiga suurendada immuunrakkude aktiivsust glioblastoomis,” kinnitas Mahajan.
Uurijad lisasid nanostruktuurile molekulaarse märgise, mis on nähtav lähiinfrapunavalguses, et jälgida selle liikumist. Leiti, et ravim liigub hiirte ninaõõnest mööda närviteed, mis ühendab näolihased ajuga, ning aktiveerib immuunrakke just kasvajapiirkonnas, vähendades sellega kõrvalmõjusid muudes kehapiirkondades.
Kasvajad kadusid täielikult ja tagasi ei tulnud
Pärast nanoravi kasutamist selgus, et STING-rada oli edukalt aktiveeritud ning immuunsüsteem muutus võitlusvõimeliseks.
Kui nanoravile lisati T-lümfotsüüte aktiveeriv ravim, kadusid kasvajad vaid ühe või kahe doosiga ning organism muutus nende vastu pikaajaliselt immuunseks. Tulemused ületasid varasemate STING-aktivaatoreid kasutavate immunoteraapiate efektiivsust.
Samas rõhutas Stegh, et ainult STING-aktivatsioon ei ole piisav glioblastoomi täielikuks ravimiseks, sest kasvajad suudavad immuunvastust mitmel viisil pärssida. Tema sõnul uuritakse nüüd võimalust kombineerida nanostruktuure mitme immuunravi mehhanismiga ühes ravilahenduses.
„See lähenemine annab lootust turvalisematele ja tõhusamatele ravivõimalustele nii glioblastoomi kui ka teiste immuunravile vastupidavate vähivormide korral. Tegemist on olulise sammuga kliinilise rakenduse suunas,“ lisas Stegh.
Viide uuringule
Loe lisaks
Koroonavaktsiin aitab vähki ravida


1 Kommentaar
Kommentaarid on suletud.